| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 지구화학 개론 - 제 5장 동위원소 지구화학 (Isotope Geochemistry) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
5-1. 동위원소의 정의 및 종류 5-2. 동위원소의 지질학적 응용 (개괄) 5-3. 방사성 동위원소를 이용한 절대 연령 측정 5-4. 안정 동위원소의 조성 5-5. 안정 동위 원소의 분별 참고문헌 5-5.안정 동위원소의 분별 5-5-1. 분별의 이유 대개의 안정 동위원소들은 그 자신의 무게에 비해 동위원소 간의 무게 차이가 상당하기 때문에, 다양한 물리화학적 작용에 대해 동위원소들의 행동이 조금씩 다르게 된다. 이와 같은 이유로 물리화학적 작용들을 통해 동위원소 비가 바뀌게 되는데, 이러한 현상을 동위원소의 분별(isotopic fractionation) 이라 한다. 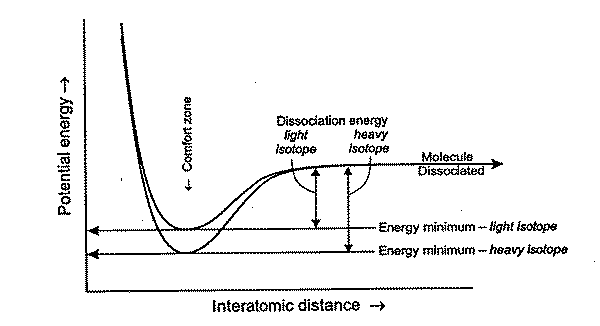 예를 들어, AB라는 화합물이 수용액 내에서 해리하는 화학적 반응을 생각해 보자. 이 화합물을 구성하는 성분 중 A는 Ah와 Al 두 가지의 상대적으로 무겁고 가벼운 동위원소로 구성되어 있다고 가정하자. 이 화합물이 수용액에서 아래와 같은 동위원소 교환반응 할 수 있다.
위 그림 5-5-1에서 보듯 가벼운 동위원소가 무거운 동위원소에 비해 해리 에너지가 적기 떄문에, 보다 많은 가벼운 동위원소가 용액 중에 풍부하게 되고, 화합물 내 동위원소 비율은 시간이 지남에 따라 점점 무거워져 평형을 이룰 때 쯤에는 최초 동위원소 비율보다 더 큰 값을 갖게 된다. 5-5-2. 분별의 표현 서로 공존하는 두 개의 상(또는 화합물) i와 j가 있다고 가정하자. 이 두 상에는 공통의 동위원소들이 있고, 이들 두 상 간에 반응이 일어나면, 앞서 설명한 이유에 따라 동위원소의 분별이 일어날 것이다. 동위원소의 분별이 얼마나 일어나는지는 보통 분별계수(fractionation factor) α를 이용해 표현하며, 이 α는 아래와 같은 식에 의해 계산된다.
예를 들면, 이산화탄소와 물의 산소 동위원소는 아래와 같이 분별된다:
즉, 이산화 탄소의 산소 동위원소 조성이 공존하는 물보다 약 40‰더 무거운 것을 나타낸다. 이는 이산화탄소와 물 간의 산소 동위원소 교환반응 결과 분별되었기 때문이다. 두 상 i와 j의 동위원소 조성과 분별계수가 아래와 같은 관계를 갖는 것은 간단히 유도할 수 있을 것이다.
동위원소의 분별은 때로 부화(enrichment; ε) 또는 분리(separation; Δ)로 나타내기도 한다. 부화와 분리는 아래와 같이 정의된다:
동위원소의 부화와 분리 값은 종종 매우 유사해서 혼용해 쓰이지만, 엄밀하게 얘기해서는 다른 값이다. 분리는 분별계수와 대략 아래와 같은 관계를 갖는다.
5-5-3. 평형 분별과 동력학적 분별(equilibrium vs kinetic fractionation) 한 (동위원소 교환) 반응에 있어, 정반응과 역반응이 충분히 진행되어 평형에 도달하였을 경우, 그 반응에 대한 동위원소 분별이 평형 분별이다. 만일, 정반응 또는 역반응 중 한 쪽의 진행이 충분치 않다거나 반응이 일방적으로 한 방향으로만 진행된다면 이 반응은 평형 상태 도달할 수 없으며, 이 때 이 반응에 대한 동위원소 분별을 동력학적 분별이라 한다. 닫힌 시스템에서의 물과 이산화탄소는 충분한 시간이 주어진다면 (보통 하루 이내) 서로 산소 동위원소를 교환하여 평형 분별을 할 것이다. 메탄 발생 박테리아(methanogens)나 황 환원 박테리아(sulfate reducers)는 각각 CO2와 SO4를 환원시켜 CH4와 H2S를 만드는데, 환경이 바뀌지 않는한 이 반응이 거꾸로 진행되지 않는다. 이 때 이 반응에 의한 탄소와 황 동위원소의 분별은 동력학적 분별이라고할 수 있다. 5-5-4. 온도에 따른 동위원소 분별 안정동위원소의 분별은 온도에 따라 민감하게 바뀐다. 이러한 특징때문에 안정동위원소의 조성을 지온계)geothermometer)로 이용하기도 하는데, 산소 동위원소를 이용한 지온계가 아마도 가장 널리 쓰이는 지온계일 것이다. 보통 온도에 따른 분별의 변화는 아래와 같이 나타낸다
위 식(5-5-7)에서 T는 절대온도이며, 이 관계가 항상 성립하는 것은 아니다. 때로 lnα가 1/T의 함수 일 수도 있고, T-3의 함수일 수도 있으며, 이 모든 항의 조합일 수도 있다. 아래 표 5-5-1은 광물과 물 간의 산소 동위원소의 온도에 따른 분별을 나타낸 것으로, 위 식 5-5-7의 계수 A와 B 값을 정리한 것이다.
[표 5-5-1] 광물-물 간의 산소 동위원소 분별의 온도에 따른 변화(Friedman and O'Neil, 1977).
5-6. 자연계에서의 안정동위원소 조성에 계속 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 |





