| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 지구화학 개론 - 제 4장 결정화학 (Crystal Chemistry) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4-1. 원자의 전자구조 - 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대한 저항도 참고문헌 4-1. 원자의 전자구조 - 주기율표 결정의 물리화학적 성질을 이해하기 위해서는 무엇보다도 먼저 결정을 구성하고 있는 원자의 구조와 화학적 특징에 대해 이해하여야 한다. 이미 우리는 원자가 핵과 전자로 구성되어 있음을 안다. 즉, 원자의 가운데에는 양성자와 중성자로 이루어진 핵이 있고, 그 주변에 전자가 둘러 싸고 있는 것이다. 양성자와 중성자는 전자에 비해 훨씬 무거운 대신, 차지하는 부피는 훨씬 적다. 그래서 원자의 무게는 핵에 의해 그리고 크기는 전자에 의해 정해진다고 볼 수 있다. 원자간의 결합 그리고 원자들의 공간적인 배열이 결정의 물리화학적 성질을 지배한다는 것은 이미 이야기 한 바 있다. 그렇다면 원자의 어떠한 부분이 그들 간의 결합과 공간적인 배열을 좌우할까? 그 것은 바로 원자의 핵 주위를 감싸고 있는 전자, 그 중에서도 최외각 전자(valence electron)이다. 그렇기 때문에 여기서 우리는 원자의 전자 구조를 다루려 하는 것이다. 원자의 전자 구조란 한 원자에서 핵을 중심으로 하는 전자의 공간적인 분포 (좀 더 엄밀하게 얘기하면, 시공간적인 분포)를 말하는 것이다. 이와 같은 전자의 분포는 소위 "궤도함수(atomic orbital)"이라는 함수에 의해서 결정되는데, 이 궤도함수는 각 전자들이 갖고 있는 양자수(quantum number)에 의해 결정된다 -사실은 양자수가 전자의 공간적 분포뿐만 아니라, 거의 모든 성질을 결정한다. 그렇다면, 우리는 원자의 전자 구조를 알기 위해서 양자수를 알아야 하겠다. - 아!! 끝도 없이 삼겹살 처럼 뭐를 이렇게 자꾸만 알아야 하는가? - 걱정할 필요 없다. 여기 내용을 여러분들이 외울 필요는 없다. 그저 맘 편히 먹고 옛날 얘기 듣듯이 해보자. 이해 못하면? 나중에 다시 한 번 더 차분히 읽어보자. 양자수와 궤도함수에 대해서 이해하기 위해서는 양자론(quantum theory)을 어느 정도 알아야 한다. 그러나, 이 강의는 양자론을 본격적으로 소개하기 위한 것이 아니다. 그러므로, 일단 양자수란 양자화된 전자의 상태를 기술하기 위한 궤도함수의 변수들이라고 정의하고 넘어가기로 하고, 양자론에 대한 자세한 것은 각자가 알아서 공부하자. 굳이 양자론에 대한 이해를 돕기 위한 책 하나를 소개하자면 McWeeny(1979)가 쓴 "Coulson's Valance"라는 책을 소개하고 싶다. 양자수에는 주양자수(principal quantum number), 방위양자수(azimuthal quantum number), 자기양자수(magnetic quantum number), 그리고 스핀양자수(spin quantum number)가 있다. 우리는 이들 양자수를 이론적인 수식을 통해 자세히 이해하기 보다는, 각각이 실제로 어떤 역할을 하는지 또는 어떤 의미가 있는지 정성적으로 이해하도록 하자. 주양자수는 핵과 전자의 거리와 전자의 양자화된 에너지를 결정하는 양자수이다. 주양자수는 n으로 표시하며, 1, 2, 3, ...등의 자연수를 갖는다 (즉, n=1,2,3,.... 이 양자수는 흔히 우리가 전자껍질(electron shell)이라고 부르던 것을 나타낸다고 보면 된다. 예를 들면, 어떤 전자의 주양자수가 2 이면 (n=2), 이 전자는 두번째 전자껍질에 있는 것이다. 이제 아래 주기율표를 보자 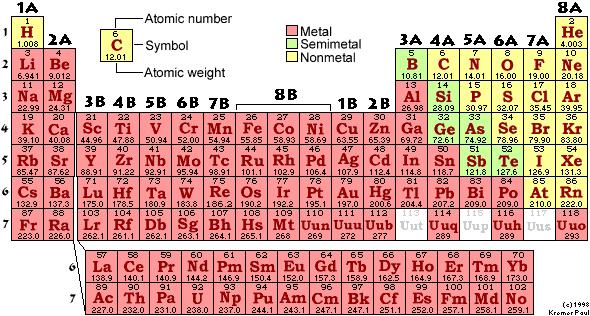 [그림 4-1-1] 원소의 주기율표 방위양자수는 전자의 각운동량과 관계된 양자수로 전자의 궤도 함수 모양, 즉 전자의 3차원적인 공간 분포 모양을 결정한다. 방위양자수는 l로 표시하는데, 이 것은 주어진 주양자수에 따라 0부터 n-1까지의 값을 갖는다 (즉, l=0, 1, 2, ...,n-1). 방위양자수에 따라 궤도 함수의 이름을 따로부르는 것이 있는데, 아마도 대부분 이 이름들을 들어봤을 것이다. 그것은 바로, s(ㅣ=0), p(ㅣ=1), d(ㅣ=2), 그리고 f(ㅣ=3) 궤도이다. 이들 궤도의 모양이 어떻게 생겼는지는 아래 그림에서 보자.
이와 같은 원자 궤도의 모양이 전자의 분포를 그대로 나타내는 것은 아니다. 이 궤도의 짝함수 (conjugate function)을 곱해서 모든 공간에 대해 적분한 것이 전자의 분포 확률을 나타내는 함수가 된다. 이 원자 궤도의 모양은 원자 홀로 있을 때의 모양이다. 다른 원자 또는 분자에 가까이 다가 가면 이 궤도 함수는 흥분되어 변형되며, 결합을 이룰 때 쯤이면 혼성 궤도를 이루는 등 상당히 다른 모습으로 변한다. 혼성 궤도에 대해서는 다음에 이야기 하자. 원소의 주기율표를 보면(그림 4-1-1), 위 왼쪽에서 오른쪽으로 1A, 2A, 3B, 4B, ...., 6A, 7A, 8A와 같은 표시를 볼 수 있을 것이다. 이 것은 족(族, group)이라 부르는데, 이 숫자 및의 세로줄에 있는 모든 원소를 원자단으로 함께 묶어 부를 때 사용된다. 예를 들면 Be부터 Ra까지 2A라 쓰인 세로줄에 있는 원소들은 2A족 원소, He부터 Rn까지의 원소들은 8A라 부른다. 이와 같이 같은 족에 속한 원소들은 최외각 전자 껍질에 같은 방위양자수를 갖는 같은 수의 전자를 갖고 있으며, 이로 인해 이들끼리는 매우 유사한 화학적 성질을 지닌다. 예를 들면, 1A 족의 원소들은 최외각 전자 하나가 s 궤도에 있는데, Li은 2s, 그 밑의 Na는 3s, 그리고 그 밑의 K는 4s의 궤도에 있다. 이와 같이 최외각 전자 껍질에 하나의 s궤도를 갖는 전자를 가진 원소를 통칭해서 알칼리 금속 원소(alkali metals)라 한다. 이왕 일련의 원소들에 대한 이름이 나온 김에 몇 개 더 소개하고 지나가자. IIA 족의 원소들은 최외각 전자 껍질에 2개의 s 궤도를 갖는 전자가 있으며, 이들을 통칭해서 알칼리 토금속 원소(alkaline earth metals)라 한다. 7A 족 원소들은 최외각 전자 껍질에 s 궤도에 2개, p 궤도에 5 개의 전자가 있는데, 이들을 할로겐 원소(halogens)라 한다. 8A 족 원소들은 0 족 원소들이라고도 하는데, s 궤도에 2 개, p 궤도에 6 개의 전자가 있어 꽉 찬 전자 구조를 갖는다. 이들은 불활성 기체 원소(inert gases)라고 한다. 3B에서 1B에 이르기까지의 10 개 족 원소들은 모두 최외각 전자 껍질에 d 궤도를 갖는 전자가 있는데, 이들 원소들을 합해 전이 원소(transient elements)라 부른다. 주기율표 밑에 두줄의 원소가 따로 있는 것을 볼 수 있을 것이다. 이 원소들은 최외각 전자 껍질에 f 궤도를 갖는 전자를 갖는 원소들이며, 함께 희토류 원소(rare earth elements)라 불린다. 이 희토류 원소 중, 윗 줄은 란타나이드 계열 원소(lanthanides), 아랫줄은 악티나이드 계열 원소(actinides)로 나뉘어 불리기도 한다. 자기양자수는 각운동량의 방향에 따른 성분과 관련된 양자수이며, 대개 하나의 방위 양자수를 갖는 궤도 함수가 공간적으로 다른 경우의 수가 얼마인가를 나타낸다고 보면된다. 자기 양자수는 m으로 표시하는데, 방위양자수에 따라 -l 부터 +l까지의 값을 갖는다 (즉, m = -l, -(l-1), -(l-2), ... -1, -2, 0, 1, 2, ..., (l-2), (l-1), l). 따라서, s 궤도(l=0)에 대해서는 m=0 값 만을 가지므로 오직 하나의 궤도만이 존재하지만, d 궤도(ㅣ=2)에 대해서는 m=-2,-1,0, 1, 2의 값을 가지므로 다섯개의 서로 다른 궤도가 존재한다. 스핀양자수는 전자가 주변 자기장에 대해 놓여진 방향을 기술하는 것으로, s로 나타내며 +1/2 또는 -1/2을 갖는다. 지금까지 4개의 양자수가 무엇을 기술하는지 그리고 실제 전자의 분포와 관련해서는 무슨 의미를 갖는지 설명하였다. 그렇다면, 만일 여러 개의 전자를 갖는 원소가 있다면, 이 원소의 전자들은 어떠한 원자궤도를 어떻게 차지하며, 각 원자 궤도에는 몇 개의 전자를 수용하는지, 그리고 결국 어떠한 궤도가 최외각 전자껍질이 되어 이 원자의 결합 및 화학적 특성을 결정하는지 알아보자.  [그림 4-1-3] 전자의 원자궤도 채움 순서 (aufbau principle).
[그림 4-1-3] 전자의 원자궤도 채움 순서 (aufbau principle).
다수의 전자가 있을 때, 전자는 우선 낮은 주양자수를 갖는 원자 궤도를 채운다. 주양자수에 따라 여러 개의 방위 양자수를 갖는데, 전자는 대개 낮은 방위양자수를 갖는 궤도를 먼저 채우나, 여기에는 일정한 예외 법칙이 있다. 이와 같이 전자가 다른 주양자수와 방위양자수를 갖는 원자 궤도를 채우는 순서를 하나의 원리로 정리하였는데, 이 것을 "aufbau principle"이라한다. 그림 4-1-3은 aufbau principle을 정리하여 나타낸 것이다. 예를 들면 조암 광물의 주 구성 원소인 Si의 경우를 살펴보자. 그림 4-1-1은 Si가 3주기의 4A족 원소임을 나타낸다. 그러니까, Si의 최외각 전자껍질에는 주양자수가 3인 궤도를 차지하는 전자가 4 개있다는 말이다. 정말 그런지 그림 4-1-3의 aufbau principle을 적용시켜보자. Si의 원자 번호는 14이므로, 14 개의 전자가 있다. 그림 4-1-3에 나타낸대로 하면 1s --> 2s --> 2p --> 3s --> 3p -->.... 이런 식으로 전자가 채워지게 되어 있다. 그런데, 각각의 원자 궤도에는 몇개의 전자가 들어갈 수 있을까? 자기양자수를 기억하자. 그러면 s 궤도는 한 개, p 궤도에는 3 개, d 궤도에는 5 개, 그리고 f 궤도에는 7 개의 다른 궤도가 있음을 알 수 있을 것이다. 이들 각각의 궤도에는 스핀 양자수가 다른 전자가 두 개씩 들어갈 수 있다. 그래서 결국, s 궤도에는 2 개, p 궤도에는 6 개, d 궤도에는 10 개, 그리고 f 궤도에는 14 개의 전자가 채워질 수 있다는 말이 된다. 그렇다면, Si는 다음과 같은 전자 구조를 가질 것이다: Si14: 1s2 | 2s22p6 | 3s23p2. 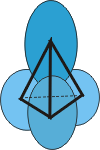 [그림 4-1-4] sp3 혼성 궤도
[그림 4-1-4] sp3 혼성 궤도자 어떤가? 위 채움 결과 정말로 Si는 최외각 전자껍질에 주양자수가 3인 궤도를 채우는 전자가 4 개 있음을 알 수 있다. 이 4 개의 전자가 Si의 결합 및 기타 화학적 성질을 결정한다. Si가 다른 원자 (또는 분자)와 점점 가까워지면, 최외각 전자들은 흥분하게 되고, 점점 s 및 p 궤도의 원래 형태를 잃게 된다. 이러한 현상이 더욱 심해지면, s와 p 궤도의 구분이 모호해지고 결국에는 s 궤도 하나와 p 궤도 3 개가 합쳐진 sp3 혼성 궤도를 만들게 된다 (그림 4-1-4). 이 혼성 궤도의 4 방향 궤도에는 각각 하나씩의 전자가 자리잡고, 이 전자들은 다른 원자 또는 분자와 결합하게 된다. 이러한 이유로 Si는 4 개의 결합팔을 갖으며 4면체 구조를 이루는 것이다. 하나의 예를 더 들어보자. K(원자번호: 19)는 4주기의 알칼리 금속에 (IA족)에 속한다 (그림 4-1-1). 그림 4-1-3에 따라 전자가 원자 궤도를 채운다면 다음과 같을 것이다: K19: 1s2 | 2s22p6 | 3s23p6 | 4s1. 위에서 3p 궤도 다음에 3d 궤도가 아닌 4s 궤도를 채운 점에 주의하자. 바로 이 점 때문에 K는 3B족의 전이원소가 아니라, 1A족의 알칼리 금속 원소가 되는 것이다. 4-2. 이온 반경과 배위수에 계속 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 |