| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 |
| 지구화학 개론 - 제 4장 결정화학 (Crystal Chemistry) |
|
4-1. 원자의 전자구조 - 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대한 저항도 참고문헌 4-3. 화학 결합의 종류와 그에 따른 물리화학적 성질 광물이 그 구성 원소로 산산히 흩어지지 않고 자신의 구조를 일정하게 유지할 수 있는 이유는 구성 원소들이 일정한 힘에 의해 서로 결합되어 있기 때문이다. 이와 같은 구성 성분간 결합을 화학 결합(chemical bonding)이라 하고, 이 결합을 유지하도록 하는 힘을 화학 결합력(bonding force)라고 한다. 화학 결합은 결합 방식의 특징에 따라 크게 다음 네 가지로 나눈다:
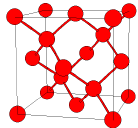
[그림 4-3-1] 다이아몬드의 결정 구조 공유 결합은 결합을 이루는 원자들이 서로 전자를 내어 전자쌍을 만들고 이를 공유하며 결합하는 것이다. 공유 결합에 의한 대표적인 광물은 다이아몬드(C)가 있다. 다이아몬드는 탄소로 구성되어 있는데, 탄소들은 sp3 혼성 궤도를 만들고 (그림 4-1-3 참조) 이 궤도의 4 개의 팔에 각각 하나씩의 전자를 배열한다. 하나의 탄소는 다른 하나의 탄소와 이 전자들을 서로 공유하며 결합하여, 마치 탄소 사면체가 3차원 적으로 끝없이 연결된 것 같은 구조를 만든다. 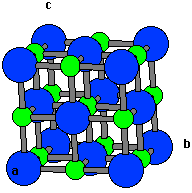 [그림 4-3-2] halite의 결정 구조. 푸른색 큰 공 = 염소, 작은
녹색 공 = 나트륨
[그림 4-3-2] halite의 결정 구조. 푸른색 큰 공 = 염소, 작은
녹색 공 = 나트륨이온 결합은 양이온과 음이온 간의 정전기적인 인력 (electrostatic atraction force) 에 의한 결합으로, 구성 원소 중의 하나는 전자를 잃어 양이온이 되고, 다른 하나는 이 전자를 얻어 음이온 됨으로써 이루어진다. 이온 결합에 의한 대표적인 광물로는 halite(NaCl; 소금)이 있다. halite의 구성 원소중 Na는 전자를 하나 잃어 양이온인 Na+가 되고, Cl은 전자를 하나 얻어 음이온인 Cl-가 된다. 이들 Na+와 Cl-는 서로 전기적 인력을 작용하며 결합하여 그림 4-3-2와 같은 halite 결정을 만든다. 금속 결합은 금속을 이루는 원소들이 이루는 결합 방식이라는 뜻에서 사용되는 용어이다. 공유 및 이온 결합의 경우 구성 원소들이 내어 놓은 전자가 결합팔 주변에 한정되어 있는데 반해 (이와 같은 전자를 편재되어(localized) 있다고 말한다), 금속 결합은 구성 원소들이 내어 놓은 전자가 결정 내에 고루 고루 분포하며 모든 구성 원소에 의해 공유되는 것처럼 행동한다 (이와 같은 전자를 비편재되어(delocalized) 있다고 말한다). 이처럼 결정 내를 자유롭게 돌아다니며 모든 원소들에 의해 공유되는 것처럼 행동하는 전자를 자유 전자(free electron)라 하는데, 이 자유 전자 때문에 금속들은 다른 물질과 구분되는 물리화학적 특징, 예를 들면 높은 전도도, 전성 연성 등을 갖게 되는 것이다. 금속 결합에 의한 대표적인 광물로는 자연금(native gold)가 있다. 이와 같은 금속 결정의 구성 원소들은 보통 육방최밀격자(hexagonal closeset packing; hcp)나 면심입방격자(face centered cubic 또는 cubic close-packing; ccp) 구조를 이룬다(그림 4-3-3).  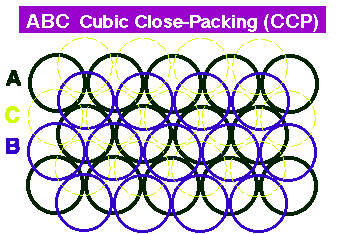 [그림 4-3-3] 육방최밀격자 및 면심입방격자의 모식도 반데르발스 결합은 전하가 없는 원자나 분자간의 약한 결합들을 통칭해서 부르는 말이다. 반데르발스 결합은 결합 속성에 따라 다시 Keesom 결합, Debye 결합, 그리고 London 결합등으로 세분된다. 이 중 처음 두 결합은 항구적 dipole의 경우에만 존재하는 결합인데 반해 런던 결합은 어느 경우에나 항상 존재하는 결합력으로, 흔히 고체를 다루는 분야에서 반데르발스 결합이라 하면 런던 결합을 의미한다. 반데르발스 결합을 하고 있는 대표적인 것은 흑연이다. 흑연은 다이아몬드와 마찬가지로 탄소로만 구성되어 있는데, 이 탄소들은 한 평면 상의 두 방향으로는 공유 결합을 통하여 매우 단단히 묶이며 판상의 구조를 이루는데 반해, 이 판과 판 사이는 반데르발스 결합으로 연결되어 매우 연약하다. 이와 비슷한 구조를 갖는 광물로는 활석이 있다. 활석의 내부 구조를 살펴보면, SiO4 사면체가 공유/이온 결합을 통해 판상으로 연결되고, 이 판 들이 반데르발스 힘에 의해 결합되어 있다. 이상에서 살펴본 결합들은 그 특성들이 각기 달라, 이러한 결합들이 어떠한 비율과 방식으로 결정을 구성하느냐에 따라 그 결정의 물리화학적 성질이 결정된다고 할 수 있다. 예를 들어, 결정들의 경도를 살펴보자. 결정의 경도는 그 결정을 구성하고 있는 결합의 결합력에 의해 좌우된다. 위 결합들 중, 가장 약한 것은 반데르발스 결합이다. 나머지 3개의 결합들은 경우에 따라 결헙력의 크기가 달라 절대적인 우열을 가리기는 힘들다. 그러나, 고체의 경우 대개 금속 결합이 자유이온의 존재로 인해 다른 두 결합 (이온 결합 및 공유 결합)보다 약하고, 이온 결합은 거리에 따른 결합력의 감소 속도로 인해 공유 결합보다 약하다. (주의: 금속 결합, 이온 결합, 및 공유 결합 간의 상대적 크기가 항상 이와 같은 것은 아니다!!).  [그림 4-3-4] 활석 (가운데 녹색의 은미정질 결정들) 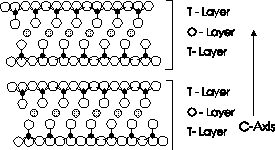 [그림 4-3-5] 활석의 결정구조
[그림 4-3-5] 활석의 결정구조모오스(Mohs) 경도계 상에서 경도 1에 해당하는 가장 약한 광물은 활석이다 (그림 4-3-4). 활석은 층상규산염광물의 하나로 Mg3Si4O10(OH)2의 화학식을 갖는다. 활석은 Si-O 사면체로 구성된 층 (T-Layer) 두 개 사이에 Mg-O(OH) 팔면체로 이루어진 층(O-Layer)이 존재하며, 이 3개의 층이 하나의 단위 층을 이루고 이 단위층이 한 방향으로 무한히 반복되는 구조를 갖는다 (그림 4-3-5). 활석의 T-Layer 내 Si-O 결합과 O-Layer 내 Mg-O(OH) 결합, 그리고 T-Layer와 O-Layer 사이의 Si-O-Mg 결합은 공유/이온 결합으로 매우 단단한데 반해 (공유/이온 결합의 의미는 다음 절인 '4-4. 전기음성도와 이온 결합성'에서 자세히 설명하도록 하자), 단위 층(T-O-T Layer) 간의 결합은 매우 약한 반데르발스 결합으로 되어 있다. 활석의 경도가 매우 약한 것은 바로 이 단위 층간의 반데르발스 결합 때문이며, 만일 활석에 이 반데르발스 결합이 없었다면 활석의 경도는 훨씬 높아졌을 것이다.  [그림 4-3-6] 결정형을 잘 보여주는 석영 (수정) 석영은 모오스 경도계 상에서 7의 경도를 갖는 광물로 활석보다 훨씬 단단하며, 만일 이 것이 크고 투명한 단일 결정으로 산출되면 '수정'이라 부르여 일종의 보석으로 취급한다 (그림 4-3-6). 석영은 망상규산염 광물의 하나로, SiO2의 화학식을 갖는다. 석영을 구성하는 Si와 O는 비교적 강한 공유/이온 결합을 하고 있으며, 이러한 결합을 하고 있는 Si-O 사면체의 각 꼭지점은 다른 Si-O 사면체와 무한히 연결되어 있다. 따라서, 석영의 경도가 활석보다 훨씬 높은 것이다. 모오스 경도계 상에서 경도가 가장 높은 광물은 다이아몬드(금강석)이다. 다이아몬드는 탄소로만 이루어진 광물로 탄소의 네 개 결합팔마다 다른 탄소가 완전한 공유결합을 하고 있다 (그림 4-3-1). 이와 같은 C-C 공유결합은 Si-O 결합보다 훨씬 강해서 다이아몬드가 석영보다 경도가 높은 것이다. 일반적으로 광물들에 있어서, 그 구성 원소간에 공유 결합 성격이 강할수록 결합력이 크며, 따라서 경도도 높다. 예를 들면, 석고, 방해석 및 형석보단 정장석이 공유결합 정도가 강하고, 정장석보단 석영 및 강옥이 더 공유 결합적인 성격이 강하며, 마지막으로 다이아몬드는 완전한 공유 결합을 한다. 물론, 항상 공유결합력이 이온결합력보다 더 강한 것은 아니다. 하지만, 광물에 있어서는 일반적으로 공유결합의 성격이 많을수록 결합력이 강한 것은 사실이다. 광물 내 구성 성분간의 결합의 종류 및 세기와 밀접한 관련이 있는 것 중의 또 다른 것이 벽개(쪼개짐)과 단구(깨짐)이다. 광물에 있어서 쪼개짐은 그 광물이 일정 방향으로 떨어져 깨지는 현상을 지칭하는 것으로, 대개 광물 내 구성 원소 간 결합 중 상대적으로 약한 결합력이 규칙성 있게 존재할 때 일어나는 현상이다. 즉, 상대적으로 약한 결합력이 있으면 다른 결합이 깨지기 전에 그 결합이 깨지게 되고, 따라서 그 약한 결합 방향에 수직 (또는 거의 수직)인 방향으로 쪼개짐 면이 발달하게 되는 것이다. 예를 하나 들어보자.  [그림 4-3-7] (001) 방향의 쪼개짐을 보여주는 흑운모의 현미경 사진 (open nicole) 흑운모는 화강암, 편암 및 편마암 등에서 흔히 관찰되는 광물로 (그림 4-3-7), 현미경 하에서 다색성, 판 형의 결정 모양, 한 방향의 뚜렷한 쪼개짐 (001 방향), 그리고 이 쪼개짐 방향에 평행한 소광 현상 등으로 다른 광물과 비교적 쉽게 구분되는 광물이다. 그렇다면, 흑운모는 왜 (001) 면과 평행하게 탁월한 쪼개짐을 보이는 것일까? 이는 흑운모의 결정 구조와 그에 따른 구성 성분간의 결합의 종류를 보면 금방 알 수 있다. 흑운모는 활석과 매우 비슷한 결정 구조를 갖고 있다 (그림 4-3-5). 흑운모가 활석과 다른 점은 T-Layer 내 Si의 1/4이 Al으로 O-Layer의 Mg의 일부가 Fe로 치환되었으며, T-O-T 단위층 사이에 이 치환으로 인한 전하 결손을 보충하기 위해 K가 존재한다는 점이다. 비록 치환이 있지만, T-Layer 내, O-Layer 내, 그리고 T-O Layer 간의 결합은 활석과 많이 다르지 않다. 그러나, T-O-T 단위 층 간의 결합은 활석과 흑운모 사이에 상당한 차이가 있다. 앞서 얘기 했듯이, 활석의 단위 층 간 결합은 반데르발스 결합인데 반해, 흑운모의 단위 층간 결합은 O-K-O로 매개 되는 이온 결합이다. 이 이온 결합은 반데르발스 결합보다는 강하지만, 층간의 공유/이온 결합 보다는 많이 약하다. 따라서, 흑운모는 스트레스를 받을 경우 이들 이온 결합으로 묶여 있는 단위층들이 서로 떨어지며 그 방향으로 탁월한 쪼개짐을 보이는 것이다. 쪼개짐과 달리 깨짐은 일정한 방향성을 보이지 않는다. 이는 당연히 광물의 구성 성분 간 결합에 있어서 특별히 약한 결합이 없거나 또는 있더라도 이 결합이 특정한 방향성을 보이지 않는 경우에 일어난다. 깨짐을 보이는 대표적인 광물이 석영인데, 앞서 얘기 했듯이 석영은 Si-O 사면체의 각 꼭지점에 다른 Si-O 사면체가 결합되어 구성 원소 간 결합에 특별히 약한 방향을 보이지 않는다. 지금까지 결합의 종류를 설명하고, 광물의 이들 결합에 따라 물성이 어떻게 결정되는지를 경도, 쪼개짐, 및 깨짐등을 예로 들어 설명하였다. 결합의 종류에 따라 이와 같은 물성 뿐만 아니라, 산 및 전기에 대한 반응성, 물과의 친화성 등 화학적 성질도 달라지게 된다. 예를 들면, 구성 성분 간의 결합이 보다 이온 결합 성격이 강하면 산이나 물과의 반응성이 높아진다. 이와 같은 반응성은 결국 광물의 풍화에 대한 저ㅏㅇ성 정도를 결정하게 되는데, 이에 대해서는 뒤에 '4-5. 정출 순서와 풍화에 대한 저항' 란에서 보다 자세하게 토론하도록 하자. 여기서 설명하지 않은 것중, 결합의 종류에 따라 화학적 성질이 달라지는 예가 있는지 각자 생각해 보고 비망록에 적어 두도록 하자. 4-4. 전기음성도와 이온결합성에 계속 |
| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 |





