| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 | ||||||||||||||||||||||||
| 지구화학 개론 - 제 4장 결정화학 (Crystal Chemistry) | ||||||||||||||||||||||||
|
4-1. 원자의 전자구조 - 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대한 저항도 참고문헌 4-2. 이온 반경과 배위수  [그림 4-2-1] 베르너 하이젠버그 (1901-1976)
[그림 4-2-1] 베르너 하이젠버그 (1901-1976)원자의 질량은 핵에 의해 결정되고, 크기는 전자에 의해 결정됨은 앞에서 설명한 바 있다. 그렇다면, 여기서 말하는 원자의 크기란 도대체 무엇일까? 그 것은 마치 당구공과 같이 전자가 핵 주위의 제한된 영역을 차지함으로써 원자가 일정한 공간을 항상 차지한다는 의미일까? 물론 그렇지 않다. 양자론의 기틀을 세우는데 매우 중요한 역할을 한 과학자중의 하나인 하이젠버그(Werner Heisenberg; 1901-1976)는 전자와 같이 작은 입자의 속도와 위치를 동시에 정확히 측정할 수 없다는 "불확정성의 원리(uncertainty principle)"를 수학적으로 증명하였다. 이 원리는 원자의 기술이 더 이상 보어(Bohr) 모델과 같은 뉴톤 물리를 사용할 수 없음을 의미하였으며, 그 대신 확률론에 근거한 양자론과 같은 전혀 새로운 체계의 수학적 기법의 도입이 필요함을 지시하였다. 이 불확정성의 원리에 따르면 전자가 정확히 어떠한 위치에 존재하는지 정할 수 없으며, 따라서 원자(또는 이온)의 크기 또한 정확히 측정할 수 없다. 그러므로, 원자의 실제크기 또는 이온의 실제 반경 같은 것은 없다고 보는 것이 타당할 것이다. 
[그림 4-2-2] 라이너스 폴링 (1901-1994) 그렇다면 여기서 얘기하는 원자의 크기 또는 이온 반경이란 무엇인가? 이 것은 분자 또는 결정을 구성하는 원자 또는 이온 핵 간의 거리를 바탕으로 계산된 가상의 크기인 것이다. 예를 들면, 염소 분자 Cl2의 염소 핵 간 거리를 측정한 후 이를 2로 나누고, 이를 염소의 반경으로 한다. 다음, 소금 결정 NaCl의 Na 핵 및 Cl 핵 간 거리를 측정한 후 이 거리에서 앞에서 계산된 염소의 반경을 빼고 난 값을 Na 이온의 반경으로 하는 식이다. 이와 같은 측정과 체계적인 자료정리는 최초 폴링(Linus Pauling; 1901-1994)에 의해서 시도되었는데, 이는 그가 결정 내 원자간 결합과 결정의 물리화학적 성질을 그의 VB (valence bond theory)로 보다 쉽게 설명하기 위해서였다. 비록, 이렇게 정해진 원자 또는 이온 반경들이 가상의 값이기는 하지만, 여러 결정 및 분자에서 마치 이들 원자와 이온들이 공 모양의 실제 크기를 갖는 것처럼 거의 일정한 값을 갖는 것이 알려졌고, 이를 이용해 분자 또는 결정의 구성 원소간 기하학적 분포와 치환에 대해 예측할 수 있음이 발견되었다. 이러한 이유로, 폴링 이후 많은 결정화학자들이 원자 및 이온의 반경을 보다 정확히 측정하려 노력하였으며, 이 과정에서 이들의 값이 결합 환경에 따라 조금씩 다름이 보다 명확하게 알려졌다. 현재 가장 많이 사용하는 원자 및 이온 반경의 값은 쉐논(R.D. Shannon)이 1976년 Acta Crystallographica에 발표한 "원소들의 유효 이온 반경" 값들이다. 이 이온 반경들은 이온의 결합 환경에 따라 자세히 세분해서 기록되어 있다. Shannon의 이온 반경의 일부를 보려면 [여기]를 눌러보자. 우리는 흔히 양이온과 음이온이 결합하여 결정을 만든다고 생각한다. 이러한 생각은 완전히 맞는 것도 그렇다고 완전히 틀린 것도 아니다. 이에 대해서는 뒤에 좀 더 자세히 얘기하기로 하고 일단은 그와 같이 이온과 이온의 결합으로 결정 또는 고상이 만들어진다고 생각하자. 이 때 하나의 이온은 다른 종류의 이온들에 의해 둘러 쌓이는데, 이를 배위(coordination)라 하고, 둘러 싸고 있는 이온들의 수를 배위수(coordination number)라 한다. 배위수는 둘러 싸인 이온과 둘러 싼 이온 간의 크기 비율, 즉 이온반경비(ionic raius ratio 또는 간단히 radius ratio)에 의해 정해진다. 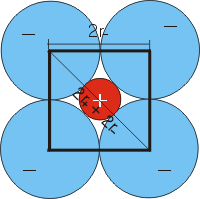 [그림 4-2-3] 팔면체의 경우 양이온 음이온 배위
[그림 4-2-3] 팔면체의 경우 양이온 음이온 배위예를 들어 보자. 만일, 양이온과 음이온이 결합하여 정팔면체 모양의 배위를 한다고 가정하자. 이 경우 정팔면체의 가운데를 수평으로 자르면 옆 그림 4-2-3과 같은 정사각형 모양의 단면을 얻을 것이다. 만일, 모든 구성 이온들이 정확하게 맞 물려서 서로 간에 조금의 빈틈도 없다면, 이 정사각형 변의 길이 ㅣ과 대각선 길이 d는 각각 l = 2r-, d = 2r- + 2r+ (4-1) 과 같이 될 것이다. 여기서 r-와 r+는 각각 음이온과 양이온의 이온 반경이다. 정사각형의 한 변과 대각선의 길이는 또한 다음과 같은 관계를 갖는다: d = √2 l (4-2) 위 (4-1) 식과 (4-2) 식을 연립하면 다음과 같은 이온 반경비를 얻을 수 있다. r+/r- = 0.414 (4-3) 즉, 양이온이 음이온의 41.4% 정도의 크기를 가지면 양이온을 중심으로 여섯 개의 음이온이 둘러 싸 (배위수=6) 팔면체 형태의 기하학적 모양을 이룰 수 있다는 말이다. 이 때 주의할 것은 위에 계산된 양이온의 크기가 팔면체를 이루기 위한 최소 크기라는 것이다. 이 보다 양이온이 크면 음이온 간의 거리가 좀 더 멀어지면 되므로 싱관 없지만 만일 더 적으면 음이온 간의 전자 구름이 겹치면서 대단히 강력한 반발에너지를 내기 때문에 결정 구조가 불안정하게 되기 때문이다. 아래 표는 위와 같은 방식으로 계산된 이온반경비와 배위수, 그리고 이로 인한 배위의 기하학적 모양을 정리한 것이다. 이 이온 반경비와 그로 인한 배위수는 전하와 함께 구성 성분간의 치환 여부를 결정하는 가장 중요한 요소이다.
[표 4-2-1] 이온 반경비에 따른 배위수 및 그 배위의 기하학적 모양
4-3. 화학 결합의 종류와 그에 따른 물리적 성질에 계속 | ||||||||||||||||||||||||
| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 |





