| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 지구화학 개론 - 제 4장 결정화학 (Crystal Chemistry) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4-1. 원자의 전자구조 - 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대한 저항도 참고문헌 4-4. 전기음성도와 이온결합성 폴링(L. Pauling)은 전기음성도 (electronegativity)란 '원자 (또는 분자)가 전자를 그 자신에게 끌어 당기려는 능력의 정도'라고 정의하였다 (Pauling, 1960). 폴링이 전기음성도를 이와 같이 정의한 것은 그가 원자가계산법(Valance Bond Method)을 통해 양자역학적 계산을 할 때, 결합의 이온결합 정도를 평가하기 위해서였다. 원래 '전기음성도'라는 용어는 폴링 이전에도 사용되었지만, 구체적인 값을 부여한 것은 폴링이 처음이다. 이때 폴링은 전기음성도를 상대적인 개념의 값으로 정의하였는데, 후에 많은 연구자들이 다양한 방법으로 전기 음성도를 절대적인 값으로 정하려 노력하였다 (표 4-4-1). 아래 표 4-4-1의 값을 살펴보면 조금씩 그 값이 다른데, 그 중 어떤 값을 사용해도 큰 문제는 없다. 다만 값을 사용할 때, 사용 목적에 맞춰 하나의 데이터 셋에서 일관되게 사용하기만 하면 된다. 우리는 이제부터 폴링의 전기음성도를 사용하기로 하자. 전기음성도는 흔히 'X'로 표시한다
[표 4-4-1] 원소들에 대한 전기음성도 값들의 비교 (단위; 폴링 단위)
우리는 이미 이온 결합 및 공유 결합에 대해 이야기하였다. 이러한 결합과 결합 구성원소의
전기음성도는 어떤 관계가 있을까?
Pauling, L. (1960) "The Nature of the Chemical Bonds" Cornell Press, N.Y., p.93. b;Sanderson, T.(196) "Inorganic Chemistry", Van Nostrand-Reinhold, N.Y., pp.72-76. c;Alled, A.L. and Rochow, E.G. (1958) J. Inorg.Nucl. Chem., 5, 264. d;From various sources. See Huheey (1978) "Inorganic Chemistry" Harper & Row, N.Y. pp.162-164. 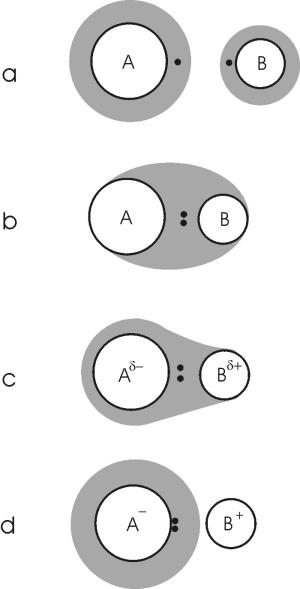 [그림 4-4-1] 결합 원소간 전기 음성도의 차이에 따른 전자의 분포 변화. 점은 전자를
음영은 전자 구름을 나타내는 것이다.
[그림 4-4-1] 결합 원소간 전기 음성도의 차이에 따른 전자의 분포 변화. 점은 전자를
음영은 전자 구름을 나타내는 것이다.a; 독립된 원자. b; XA = XB 완전한 공유결합. c; XA > XB 부분 공유결합 / 부분 이온결합. d; XA >> XB 거의 완전한 이온결합. 옆의 그림 4-4-1과 같이 결합을 이루는 두 개의 원자 A와 B를 생각해보자. 이들 두 원자가 무한히 떨어져 서로 아무런 결합을 이루지 않을 때는, 각 원자의 전자 구름은 아무런 뒤틀림 없이 정상적으로 분포할 것이다 (그림 4-4-1a). 만일 이 두 원자가 서로 가까이 다가서고 급기야 화학 결합을 이루면 각 원자 A와 B의 최외각 전자는 결합 궤도를 만들고 이 궤도 상에 존재하게 된다. 이때 만일 두 원자의 전기음성도가 같다면, 즉 XA = XB 이면 결합을 이루는 전자는 A와 B 어느 쪽에도 치우치지 않고 그 사이에 존재하며 양쪽 원자에 의해 완벽하게 공유된다 (그림 4-4-1b). 이러한 경우가 바로 이상적인 공유 결합이다. 만일 결합을 이루는 두 원자중 A의 전기음성도가 B보다 훨씬 크다면, 즉 XA >> XB라면 결합 전자는 A쪽으로 완전히 끌려서 존재하게 된다 (그림 4-4-1d). 이 것은 결과적으로 A는 전자를 하나 얻어 -1가 이온이 되고 B는 전자를 잃어 +1가 이온이 되는 것과 같으며, 이렇게 만들어진 이온 간에는 정전기적 인력이 작용한다. 이 것이 바로 이상적인 이온 결합이다. 이상적인 공유결합의 예는 같은 원자 간의 결합, 즉 다이아몬드, 흑연, 질소 분자 등에서 쉽게 찾아볼 수 있다. 그러나, 이상적인 이온 결합의 예는 흔치 않다. 왜냐하면, 결합을 이루는 원자 간 전기음성도의 차이가 아무리 크다 해도 전자를 완전히 뺏기고 뺏어 이온이 되기는 쉽지 않기 때문이다. 이온 결합의 예로 자주 인용되는 소금 (NaCl)의 경우도 Na와 Cl 간의 전기음성도 차이가 완전한 양이온과 음이온을 만들 정도로 충분히 크지 못하다. 실제로 자연계에서의 대부분의 결합은, 같은 원소 간의 결합을 제외하고는, 부분적인 이온 결합 (따라서 부분적인 공유 결합)을 하고 있다. 이 경우 이온 결합의 정도는 결합을 이루는 두 원소간 전기음성도 차이에 따라 결정된다 (그림 4-4-1c). 폴링은 두 원자 간의 결합에 있어서 이온결합정도(ionicity)를 다음과 같은 식을 통해 계산하였다: I = 1 - exp[-0.25(XA - XB)2]. (4-4) 여기서, I = 이온결합정도이며, XA 및 XB는 결합을 이루는 두 원소 A와 B의 전기음성도 이다. 핸네이와 스마이스 (Hannay and Smyth, 1946)는 폴링의 식에 의해 계산된 이온 결합 정도와 실험실에서 측정된 이온 결합 정도를 비교하였다. 그 결과, 폴링의 식이 이온 결합성이 높을수록 이온 결합 정도를 과대 평가한다는 것을 발견하였다. 이에 그들은 실험 측정 값에 맞는 다음과 이온결합정도 평가식을 제시하였다: I = 0.16(XA - XB) + 0.035(XA - XB)2. (4-5) 이때 반드시 XA>XB이어야 한다. 이 밖에도 몇몇 연구자들에 의해 이온결합정도를 평가하는 방법이 제시되었으나, 우리는 헨내이와 스마이스 방법을 이용하기로 하자. 식 (4-4) 및 (4-5)는 단순히 두 개의 원자가 결합을 이룰 경우 그 결합의 이온결합정도를 평가하는 식이다. 만일, 우리가 흔히 다루는 광물에서와 같이 하나의 원자가 여러 개의 다른 원자에 의해 배위되면서 결합을 이룬다면 다음과 같이 이온 결합 정도를 평가하여야 한다: Ic = (N/M)I + (1-N/M). (4-6) 여기서, Ic는 배위된 결합의 이온결합정도이며, N은 배위된 원자의 원자가 전자수(number of valance electrons), M은 배위수(coordination number)이다. 아래 표 4-4-2는 규산염 광물에서 흔히 나타나는 결합의 이온결합정도를 위 식 (4-6)에 의해 계산한 결과를 정리한 것이다.
[표 4-4-2] 결합 원소의 종류 및 배위수에 따른 이온결합정도
우리는 규산염 광물의 구조 기본 단위인 Si-O 사면체를 +4가의 Si와 -2가의 O가 결합하여 만들었다는 말을 듣는다. 이 말은 맞는 말이다. 위 몇 가 하는 것은 바로 원자가 전자수 (valence electron number)를 의미하는 것이다. 그러나, 이를 +4가의 Si 양이온과 -2가의 O 음이온이 이온 결합하여 만들었다고 하면 틀린 것이다. 위 표 4-2-2이 이온결합정도 계산 결과를 보면, 사면체에서의 Si-O 결합의 이온 결합 정도는 겨우 33% 밖에 되지 않는것을 알 수 있다. 오히려 이 결합은 공유결합 성격이 67%나 되, 차라리 공유결합에 가깝다고 할 수 있을 것이다. 또 한 가지 위 계산에서 재미 있는 것은 흔히 전하 균형을 맞추기 위해 치환하는 원소들에 관한 것이다. 이 원소들은 K, Na, Ca 등인데, 규산염 광물 내에서 대개 6-12의 배위수를 갖는다. 이러한 원소들의 이온결합정도는 대부분 90%넘어, 우리가 이들의 결합을 이온 결합이라 부르는 것이 크게 틀리지 않음을 알 수 있다. 4-5. 정출 순서와 풍화에 대한 저항도에 계속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 차례 | 제 1장 | 제 2장 | 제 3장 | 제 4장 | 제 5장 | 제 6장 | 제 7장 | 제 8장 |





